INDICE
2.12 TEORÍA DE BANDAS
2.13 ESTRUCTURA DE LOS MATERIALES
2.14 ESTADO SÓLIDO (CRISTALINO)
2.15 CONCEPTO Y CARACTERIZACIÓN DE SISTEMAS CRISTALINOS
2.16 ESTADO VÍTREO
2.17 ESTRUCTURA AMORFA
2.18 PROPIEDADES CARACTERÍSTICAS DE UN MATERIAL VÍTREO
2.19 METALURGIA. PRINCIPALES METALES Y ALEACIONES UTILIZADOS EN LA INDUSTRIA
2.12 TEORÍA DE BANDAS
La teoría de bandas está basada en la mecánica cuántica y procede de la teoría de los orbitales moleculares (TOM). En esta teoría, se considera el enlace metálico como un caso extremo del enlace covalente, en el que los electrones de valencia son compartidos de forma conjunta y simultánea por todos los cationes. Desaparecen los orbitales atómicos y se forman orbitales moleculares con energías muy parecidas, tan próximas entre ellas que todos en conjunto ocupan lo que se franja de denomina una “banda de energía”.Aunque los electrones van llenando los orbitales moleculares en orden creciente de energía, estas son tan próximas que pueden ocupar cualquier posición dentro de la banda. La banda ocupada por los orbitales moleculares con los electrones de valencia se llama banda de valencia, mientras que la banda formada por los orbitales moleculares vacíos se llama banda de conducción. A veces, ambas bandas se solapan energéticamente hablando. Este modelo explica bastante bien el comportamiento eléctrico no solo de las sustancias conductoras sino también de las semiconductoras y las aislantes. En los metales, sustancias conductoras, la banda de valencia se solapa energéticamente con la banda de conducción que está vacía, disponiendo de orbitales moleculares vacíos que pueden ocupar con un mínimo aporte de energía, es decir, que los electrones están casi libres pudiendo conducir la corriente eléctrica.

En los semiconductores y en los aislantes, la banda de valencia no se solapa con la de conducción. Hay una zona intermedia llamada banda prohibida.En los semiconductores, como el Silicio o el Germanio, la anchura de la banda prohibida no es muy grande y los electrones con suficiente energía cinética pueden pasar a la banda de conducción, por esa razón, los semiconductores conducen la electricidad mejor en caliente. Sin embargo, en los aislantes, la banda prohibida es tan ancha que ningún electrón puede saltarla. La banda de conducción está siempre vacía.
2.13 ESTRUCTURA DE LOS MATERIALES
Una celda unitaria es la unidad estructural que se repite en un sólido, cada sólido cristalino se representa con cada uno de los siete tipos de celdas unitarias que existen y cualquiera que se repita en el espacio tridimensional forman una estructura divida en pequeños cuadros. A un modelo simétrico, que es tridimensional de varios puntos que define un cristal se conoce como una red cristalina. La clasificación que se puede hacer de materiales, es en función de cómo es la disposición de los átomos o iones que lo forman. Si estos átomos o iones se colocan ordenadamente siguiendo un modelo que se repite en las tres direcciones del espacio, se dice que el material es cristalino.Si los átomos o iones se disponen de un modo totalmente aleatorio, sin seguir ningún tipo de secuencia de ordenamiento, estaríamos ante un material no cristalino ó amorfo.
Los materiales están divididos en:
Metálicos: estos materiales son sustancias inorgánicas que están compuestas de uno o más elementos metálicos, pudiendo contener también algunos elementos no metálicos, ejemplo de elementos metálicos son hierro cobre, aluminio, níquel y titanio mientras que como elementos no metálicos podríamos mencionar al carbono.
Los materiales están divididos en:
Metálicos: estos materiales son sustancias inorgánicas que están compuestas de uno o más elementos metálicos, pudiendo contener también algunos elementos no metálicos, ejemplo de elementos metálicos son hierro cobre, aluminio, níquel y titanio mientras que como elementos no metálicos podríamos mencionar al carbono.

Cerámica: como los ladrillos, el vidrio la loza, los aislantes y los abrasivos, tienen escasas conductividad tanto eléctrica como térmica y aunque pueden tener buena resistencia y dureza son deficientes en ductilidad, confortabilidad y resistencia al impacto.

Polímeros: en estos se incluyen el caucho (el hule), los plásticos y muchos tipos de adhesivos. Se producen creando grandes estructuras moleculares a partir de moléculas orgánicas obtenidas del petróleo o productos agrícolas.

2.14 ESTADO SOLIDO (CRISTALINO).
A temperatura ambiente la mayoría de los materiales de la corteza terrestre son sólidos como por ejemplo la arena, el cuarzo la piedra caliza, las rocas etc. Es el estado de agregación que predomina en la naturaleza. Los sólidos se pueden dividir en dos formas: en amorfos y cristalinos. Un sólido cristalino: Se caracteriza por poseer rigidez y orden de largo alcance; sus moléculas, átomos o iones ocupan posiciones específicas. El centro de cada una de las posiciones se llama punto reticular, y el orden geométrico de estos puntos reticulares se llama estructura cristalina. Son ejemplos de estos sólidos las sales inorgánicas, los metales, muchos compuestos orgánicos, los gases solidificados (hielo seco: dióxido de carbono), etc. Sólidos Amorfos: Sus moléculas carecen de disposición definida, de orden molecular de largo alcance. Ej: el vidrio, el fósforo rojo, la resina, el azufre amorfo y muchos materiales plásticos.
| tipos de celdas unitarias. |
“TIPOS DE SÓLIDOS “
Solidos Iónicos: Están constituidos por especies cargadas: iones positivos (cationes) y los iones negativos (aniones). dichos iones se encuentran unidos por medio de fuerzas electrostáticas. Son duros quebradizos, de alto punto de fusión, malos conductores del calor y de la electricidad. Ej. NaCl, LiF, MgO.
Si consideramos la estructura del NaCl, red cubica centrada en las caras, se podrá observar que la longitud de la arista de la celda unitaria es el doble de la suma de los radios ionices de Na+ y Cl -.
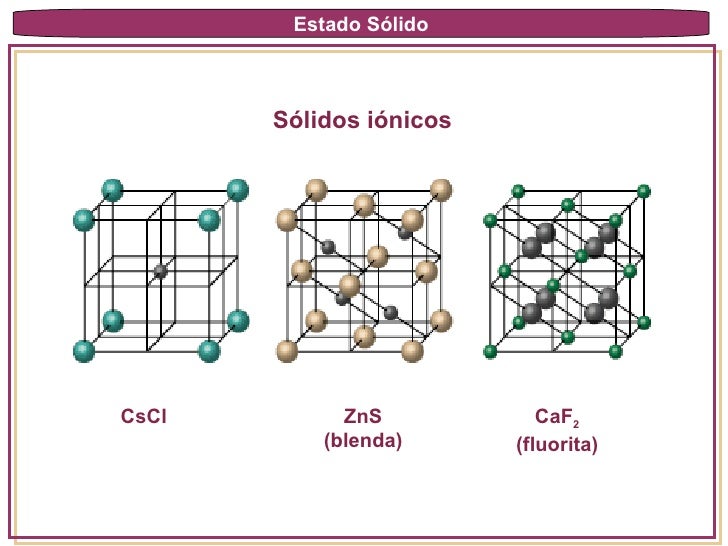
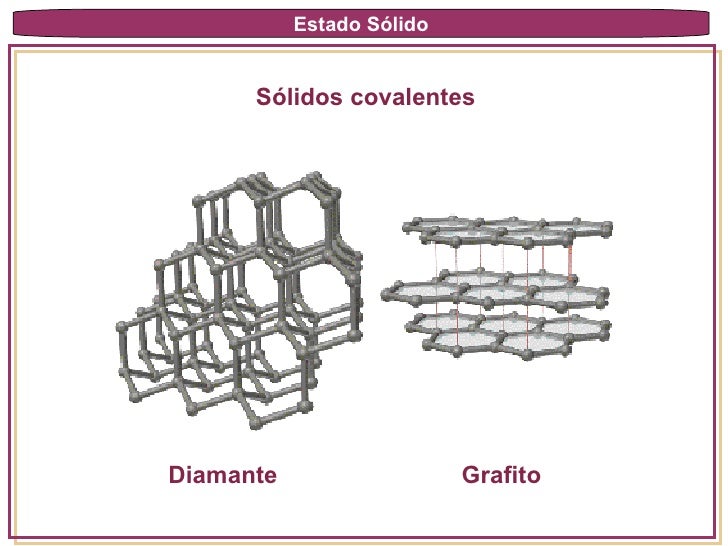
Sólidos Covalentes: Están formadas por átomos enlazados por uniones covalentes en una red que se extiende entre dimensiones. Son ejemplos bien conocidos los dos ALÓTROPOS del carbono: el diamante y el grafito. En el diamante cada átomo esta unida a otros 4 átomos de C. En el grafito, los átomos de carbono están acomodados enanillos de 6 miembros. Estos sólidos son duros, de alto punto de fusión, malos conductores de calor y de la electricidad (excepto el diamante que es un buen conductor térmico).
Otro tipo de cristal covalente es el cuarzo, este es parecido al diamante en muchos aspectos, tales como dureza y punto de fusión alto.
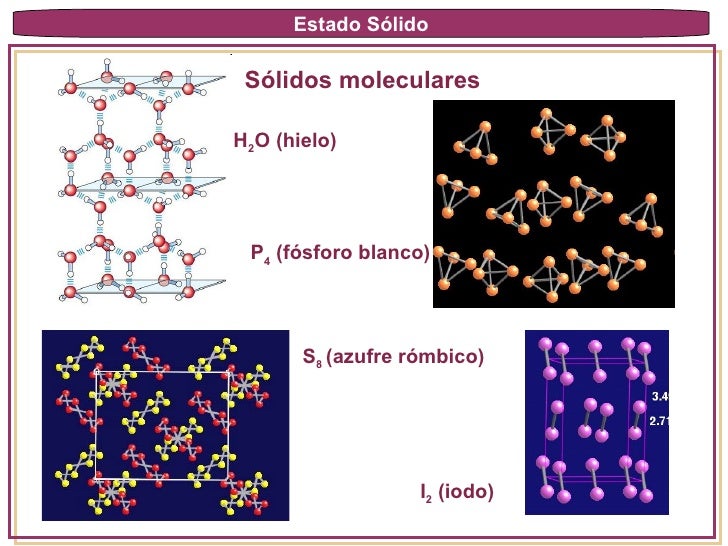
Sólidos Moleculares: Es un cristal molecular, los puntos reticulares están ocupados por moléculas y las fuerzas de atracción entre ellas son del tipo Van der Waals y/o enlaces hidrógenos. Un ejemplo de este tipo de cristales el dióxido de azufre sólido, en el cual la fuerza de atracción predominante es de interacción dipolo-dipolo. los enlaces hidrógenos intermoleculares son los responsables de mantener la red tridimensional del hielo. Otros ejemplos: Son el yodo. P4,S8, sacarosa, agua, etc.
Estos sólidos son suaves, bajo punto de fusión, malos conductores del calor y de la electricidad.
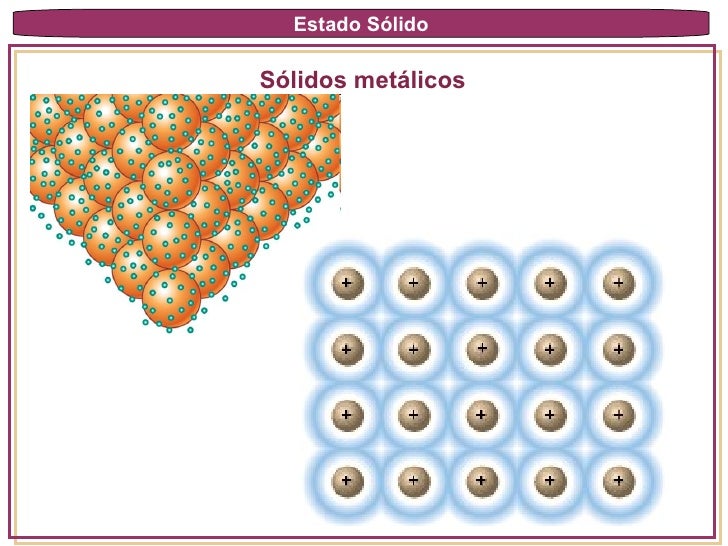
Sólidos Metálicos: Cada punto de su red esta ocupada por un átomo del mismo metal. Los cristales metálicos son del tipo cubico centrados en el cuerpo, cúbicos centrados en las caras o hexagonales compactos. Los átomos se hallan unidos por medio de enlaces metálicos. Son suaves o duros, de bajos a altos puntos de fusión, buenos conductores de calor y de la electricidad. Ej. Todos los elementos metálicos como el Fe, Cu, Mg, etc.
2.15 CONCEPTO Y CARACTERIZACIÓN DE SISTEMAS CRISTALINOS
EL CONCEPTO DEL CRISTAL
Un cristal es un sólido homogéneo que presenta una estructura interna ordenada de sus constituyentes químicos, sean átomos, iones o moléculas. La estructura cristalina, no es exclusiva de los minerales. Hay muchas sustancias cristalinas de origen orgánico, como el azúcar o las concreciones calcáreas de las conchas de moluscos, o de origen artificiales, como el acetato de plomo.
ESTRUCTURA CRISTALINA
La celda fundamental o celda unitaria o malla es la distribución de átomos, iones o moléculas más pequeñas, cuya repetición definida origina todo el conjunto cristalino.
En teoría este proceso se podría repetir indefinidamente hasta que se obtuviera el más pequeño conjunto de átomos, ordenados del mismo modo, y con la misma forma de cada uno de los fragmentos mayores. Estaríamos, entonces, ante la celda fundamental del cristal las formas poliédricas de caras planas, típicas de las sustancias cristalinas, indican que el cristal crece a diferentes velocidades en las distintas direcciones del espacio.
Un cristal se origina por acumulación de un pequeño conjunto de átomos. En consecuencia, si el crecimiento se produjera a la misma velocidad en todas las direcciones, los cristales serían esféricos.
La disposición ordenada de los constituyentes químicos en sucesiones a lo largo de los ejes, y los planos del cristal, es decir, en las tres direcciones del espacio, forman una red cristalina.
Repetición de la celda inicial en todos los espacios.
LOS NODOS
Cada uno de los constituyentes químicos, considerados, como puntos geométrico, recibe el nombre de nudo o nodo. Esto se les ponen en filas y se repite cada cierta distancia característica, denominada periodo.
EL PLANO RETICULAR
Un conjunto de filas paralelas y equidistantes. Los espacios delimitados por los nodos, se denominan mallas. Las redes planas se forman geométricamente con la translación en dos direcciones de los constituyentes químicos que forman el cristal.
La intersección de varias filas originaría un nodo. Los constituyentes químicos se sitúan, normalmente, en estas intersecciones, aunque no siempre es así. También ocupan otros lugares como el centro de las caras de la celda fundamental. (pueden aparecer en medio).
EL RETÍCULO ESPACIAL
La superposición de varios planos reticulares da lugar al retícula espacial
Una línea del retículo corresponden a la arista del cristal
Un plano corresponde a la cara del cristal
El retículo se correspondería con el propio cristal
LOS ELEMENTOS DE SIMETRÍA
En los cristales, se pueden definir tres clases de elementos de simetría: ejes, planos y centros
Un eje de simetría es una línea que pasa por el centro del cristal, el cristal al dar la vuelta entorno a ella, ocupa 2, 3, 4, ó 6, veces la misma posición.
Si la posición se ocupa dos veces es binario
Si la posición se ocupa tres veces es ternario
Si la posición se ocupa cuatro veces es cuaternario
Si la posición se ocupa seis veces es senario
Un plano de simetría es un plano que divide el cristal en dos partes, cada una de las cuales es la imagen especular de la otra.
Un centro de simetría es un punto interior del cristal que divide en dos partes iguales a cualquier segmento, pase por el y enlaza juntos equivalentes.
LOS SISTEMAS CRISTALINOS
Existen 32 clases de cristales según sus características de simetría, que se organizan en 14 tipos de redes tridimensionales, las 14 redes de Bravais.
El número de combinaciones posibles de los elementos de simetría es finito.
La posesión de elementos de simetría en común permite agrupar las 32 clases cristalinas en 7 grupos, los sistemas cristalinos. Estos sistemas quedan definidos por las constantes cristalográfica, es decir, el tamaño característico de las aristas, y el ángulo que forman entre si en la s celdas fundamentales de cada tipo de cristal.
Los sistemas cristalinos son: cúbico o isométrico, triclínico, monoclínico, rómbico, tetragonal, hexagonal y trigonal o romboédrica.
Cada celda unidad queda determinada por la longitud de sus aristas a, b, y c que se cortan en un punto, y por el valor de sus ángulos ð, ð, γð que forma dichas aristas. Estos valores reciben el nombre de constantes cristalográficas y varían de una celdas a otras.
En la naturaleza existen siete tipos de células fundamentales, que se llaman: triclínico, monoclínico, cúbico, rómbico, hexagonal, romboédrico, tetragonal.
En ocasiones la estructura interna de los edificios cristalinos, presenta imperfecciones debidas a impurezas dentro de la red cristalina o a la sustitución de unas partículas elementales por otras. Por ello se forman cristales defectuosos. Estos defectos, originas determinados colores, contribuyen a la formación de piedras preciosas, permiten la flexibilidad de algunos metales o aumentan su resistencia y dureza. El ser humano aprueba estas imperfecciones en importantes aplicaciones, como en el funcionamiento de transistores y del láser.
2.16 ESTADO VÍTREO
El estado vítreo es amorfo, caracterizado por la rápida ordenación de las moléculas para obtener posiciones definidas. Los cuerpos en estado vítreo se caracterizan por presentar un aspecto sólido con cierta dureza y rigidez y que ante esfuerzos externos moderados se deforman de manera generalmente elástica. Sin embargo, al igual que los líquidos, estos cuerpos son ópticamente isótropos, transparentes a la mayor parte del espectro electromagnético de radiación visible. Cuando se estudia su estructura interna a través de medios como la difracción de rayos X, da lugar a bandas de difracción difusas similares a las de los líquidos. Si se calientan, su viscosidad va disminuyendo paulatinamente –como la mayor parte de los líquidos- hasta alcanzar valores que permiten su deformación bajo la acción de la gravedad, y por ejemplo tomar la forma del recipiente que los contiene como verdaderos líquidos. No obstante, no presentan un punto claramente marcado de transición entre el estado sólido y el líquido o "punto de fusión".
Todas estas propiedades han llevado a algunos investigadores a definir el estado vítreo no como un estado de la materia distinto, sino simplemente como el de un líquido subenfriadoo líquido con una viscosidad tan alta que le confiere aspecto de sólido sin serlo. Esta hipótesis implica la consideración del estado vítreo como un estado metastable al que una energía de activación suficiente de sus partículas debería conducir a su estado de equilibrio, es decir, el de sólido cristalino.

Las sustancias susceptibles de presentar un estado vítreo pueden ser tanto de naturaleza inorgánica como orgánica, entre otras:
- Elementos químicos: Si, Se, Au-Si, Pt-Pd, Cu-Au.
- Óxidos: SiO2, B2O3, P2O5, y algunas de sus combinaciones.
- Compuestos: As2S3, GeSe2, P2S3, BeF2, PbCl2, AgI, Ca(NO3)2.
- Siliconas (sustancias consideradas como semiorgánicas)
Polímeros orgánicos: tales como glicoles, azúcares, poliamidas,poliestirenos o polietilenos, etc.
2.17 ESTRUCTURA AMORFA
Las estructuras amorfas, las subestructuras siguen líneas quebradas al azar y el orden sólo se discierne a corta distancia. En la difracción también se refleja esta diferencia; la imagen que produce un haz de partículas -fotones, electrones, neutrones- que incide en un cristal amorfo conlleva un punto de impacto central, que corresponde a las partículas no desviadas, rodeado de anillos que corresponden a las distancias medias que son las más frecuentes entre los átomos. Pero, cuando el haz incide en un cristal, la perfecta periodicidad de las estructuras atómicas implica difracciones regulares de las partículas, que tienen lugar en direcciones privilegiadas y características de la estructura del cristal.

La imagen se asemeja a una rejilla, en la que se distinguen unos puntos espaciados de forma regular que se llaman reflexiones de Bragg.
Descripción de las propiedades de los sólidos amorfos.
Un sólido amorfo consiste en partículas acomodadas en forma irregular y por ello no tienen el orden que se encuentra en los cristales. Ejemplos de sólidos amorfos son el vidrio y muchos plásticos.
Los sólidos amorfos difieren de los cristalinos por la manera en que se funden. Si controlamos la temperatura de un sólido cristalino cuando se funde, encontraremos que permanece constante. Los sólidos amorfos no tienen temperatura de fusión bien definida; se suavizan y funden en un rango de temperatura y no tienen “punto de fusión” característico.
Los sólidos amorfos, al igual que los líquidos y gases, son isotrópicos, es decir sus propiedades son iguales en todas las direcciones. Esto se debe a la falta de regularidad en el ordenamiento de las partículas en los sólidos amorfos, lo cual determina que todas las direcciones sean equivalentes.
La característica más notoria de estos materiales es la ausencia de orden de largo alcance. Esto significa que, al contrario de lo que ocurre en un cristal, el conocimiento de las posiciones atómicas de una región no nos permite predecir cuales serán las posiciones atómicas en otra región más o menos distante. A corto alcance sólo en el caso de los gases se puede realmente hablar de aleatoriedad, ya que tanto en los líquidos como en los gases se observan valores de densidad que sólo son compatibles con empaquetamientos más o menos compactos de átomos. Ahora bien, la obtención de estos empaquetamientos impone ciertas restricciones, esto es lo que nos permite hablar de orden de corto alcance. Este orden de corto alcance está siempre presente, sin embargo entre el sólido cristalino y el líquido hay bastantes diferencias, mientras que entre el líquido y el sólido amorfo encontramos bastantes semejanzas. Sin embargo el número de átomos que rodea a un átomo dado y la distancia interatómica media son similares en las fases sólida y líquida como corrobora la similitud encontrada en los valores de la densidad de cada fase. Básicamente hay tres modelos que intentan explicar la estructura de un amorfo.
2.18 PROPIEDADES CARACTERÍSTICAS DE UN MATERIAL VÍTREO
Estado de la materia caracterizado por poseer una disposición atómica que no muestra una estructura ordenada de largo alcance, como es característico del estado cristalino. El aspecto atómico es el de un líquido, con los átomos distribuidos en posiciones aleatorias y cuyo único rasgo de cierta regularidad es una separación entre átomos vecinos aproximadamente constante. Sin embargo, el tiempo de permanencia de estos átomos en sus posiciones de equilibrio es relativamente.
Podemos definir a un vidrio como un líquido que ha perdido su habilidad para fluir, o bien, como un material sólido amorfo con características estructurales de líquido y que presenta una transición vítrea. La manera más fácil de formar un vidrio es enfriando un líquido lo suficientemente rápido para evitar que la cristalización ocurra.
El vidrio común contiene aproximadamente el 70-72% en peso de dióxido de silicio (SiO2). La materia prima principal es la arena (o "arena de cuarzo) que contiene casi el 100% de sílice cristalina en forma de cuarzo. A pesar de que se trata de un cuarzo casi puro, todavía se puede contener un poco (<1%) de óxidos de hierro que el color del vidrio, por lo general, esta arena es enriquecido en la fábrica para reducir la cantidad de óxido de hierro de <0,05%. Grandes cristales de cuarzo natural único son el dióxido de silicio puro, y que, a la trituración, se utilizan para las gafas especiales de alta calidad.
Las sustancias susceptibles de presentar un estado vítreo pueden ser tanto de naturaleza inorgánica como orgánica, entre otras:
*
Elementos químicos: Si, Se, Au-Si, Pt-Pd, Cu-Au.
*
Óxidos: SiO2, B2O3, P2O5, y algunas de sus combinaciones.
Compuestos: As2S3, GeSe2, P2S3, BeF2, PbCl2, AgI, Ca(NO3)2.
Siliconas (sustancias consideradas como semiorgánicas)
Polímeros orgánicos: tales como glicoles, azúcares, poliamidas, poliestirenos o polietilenos, etc.
2.19 METALURGIA. PRINCIPALES METALES Y ALEACIONES UTILIZADOS EN LA INDUSTRIA.

La metalurgia es la técnica de la obtención y tratamiento de los metales a partir de minerales metálicos. También estudia la producción de aleaciones, el control de calidad de los procesos. La metalúrgica es la rama que aprovecha la ciencia, la tecnología y el arte de obtener metales y minerales industriales, partiendo de sus menas, de una manera eficiente, económica y con resguardo del ambiente, a fin de adaptar dichos recursos en beneficio del desarrollo y bienestar de la humanidad.
Metal: Cada uno de los elementos químicos buenos conductores del calor y de la electricidad, con un brillo característico y sólidos a temperatura ordinaria, salvo el mercurio.

Hierro:Es un metal reductor que se combina principalmente con el oxígeno, el azufre y el cloro. Reduce los ácidos cuyo anión no es reducible produciendo un desprendimiento hidrógeno, cosa que sucede con el ácido clorhídrico y el ácido sulfúrico. Con los ácidos cuyo anión es reducible, la acción del hierro es mucho más compleja.

Cobre:Metal rojizo, maleable y dúctil. Es un excelente conductor de la electricidad. Se encuentra libre en la naturaleza (cobre nativo), combinado con el oxígeno, y aparece en cantidades variables en los minerales de plata, hierro, antimonio, etc. Sus métodos de obtención se agrupan en dos grupos: por vía seca, que consiste en una serie de oxidaciones, fusiones y reducciones de los minerales, con el fin de aumentar su contenido en cobre y obtener un metal casi puro; y por vía húmeda, en el que se tuestan primero los minerales con el sulfuro de hierro o pirita, transformándose el cobre en sulfato, y posteriormente queda el metal libre por reducción de esa sal con chatarra de hierro.

Plomo:Tiene un aspecto plateado grisáceo; aunque recién cortado es brillante, va perdiendo brillo al oxidarse en contacto con el aire, y con los ácidos forma sales venenosas. Es un metal pesado, dúctil, maleable, blando y flexible; por lo que es muy fácil de modelar. Su número atómico es el 82, su peso atómico 207'22, y su símbolo el Pb.
Zinc:Presenta una coloración blanca azulada. Es un metal algo blando. Cuando se funde es frágil, sin embargo, cuando está laminado adquiere una mayor resistencia, e incluso es posible darle forma.

Aluminio:Metal de colores y brillo similares a los de la plata, ligero y dúctil, muy maleable, por lo que puede presentarse en hilos y demás formas, buen conductor de calor y de la electricidad y resistente a la oxidación. Es un metal blando; tiene poca resistencia a la rotura y bajo límite elástico. Tiene un buen poder reflector. Su densidad en estado sólido es de 2'7; Su punto de fusión es de 660ºC y su temperatura de ebullición, de 2500ºC. Es un metal muy reactivo. Se combina en caliente con los halógenos, el oxígeno el nitrógeno y el carbono.

Principales aleaciones utilizadas en la industria:
Alnico: Aleación formada principalmente de cobalto, aluminio y níquel aunque también puede contener hierro, cobre y en ocasiones titanio. Su uso principal es en aplicaciones magnéticas. Las aleaciones de álnico son ferromagnéticas y se usan para hacer imanes permanentes. Antes del desarrollo de imanes de tierras raras en la década de 1970, fueron el tipo más fuerte de imán.

Acero: aleación de hierro y carbono donde el carbono no supera el 2,1% en peso[ de la composición de la aleación, alcanzando normalmente porcentajes entre el 0,2% y el 0,3%. Porcentajes mayores que el 2,0% de carbono dan lugar a las fundiciones aleaciones que al ser quebradizas y no poderse forjar a diferencia de los aceros, se moldean.

Alpaca: aleación ternaria compuesta por zinc, cobre y níquel con un color y brillo parecido al de la plata . Las aleaciones que contienen más de un 60% de cobre son monofasicas y se caracterizan por su ductibilidad y por la facilidad para ser trabajadas a temperatura ambiente , la adición de níquel confiere una buena resistencia a los medios corrosivos.

Cobre: aleación metalica de cobre y estaño en la que el primero constituye su base y el segundo aparece en una proporción de entre el 3 y el 20%.

Constantán: Aleación generalmente formada por un 55% de cobre y un 45% de níquel (Cu55Ni45). Se caracteriza por tener una resistencia eléctrica constante en un amplio rango de temperaturas, es uno de los materiales más utilizados para la fabricación de monedas.

Magnam: aleación de magnesio (mg) que se le añade manganeso (mn), aluminio (al) y zinc (zn). Es un metal muy difícil de conseguir ya que solo se usa para experimentos y construcción de solo algunos instrumentos.

Nicrom: Aleación de níquel, cromo está compuesta de un 80% de niquel y un 20% de cromo. Es de color gris y resistente a la corrosión , con un punto de fusión cercano a los 1400°. Por su gran resistividad y su difícil oxidación a altas temperaturas, es muy utilizado en la confección de resistencias para elementos calefactores, como secadores de pelo, hornos eléctricos y tostadoras.
Oro blanco: Aleación de oro y algún otro metal blanco, como la plata , el platino, paladio , o níquel , muchas veces recubierta de rodio de alto brillo. Esta aleación es muy usada en joyería, Una mezcla que fue muy usada por un tiempo, contiene dos a cuatro partes de oro y una parte de plata.

Peltre: Aleación compuesta por estaño, cobre, antimonio y plomo. Es maleable, blando y de color blanco con alguna similitud a la plata, poco reactivo y funde a 320 ºC por lo que su utilización para adornos es muy común.

Zamak: Aleación de cobre, zonz con aluminio , magnesio y cobre.Tiene dureza, resistencia a la tracción, y temperatura de fusión de 386 °C.. Es un material barato, posee buena resistencia mecánica y deformabilidad plástica, y buena maleabilidad. Se puede cromar, pintar y mecanizar.





No hay comentarios.:
Publicar un comentario